我院池在龙团队揭示外周血来源小细胞外囊泡参与青光眼视神经损伤的全身调节机制
青光眼是全球首位不可逆致盲性眼病,以特征性视神经萎缩和进行性视野缺损为共同特征。据估计到2040年全球将有超过一亿的青光眼患者,经治疗仍有患者不可逆性视力损伤甚至失明。因此,早期诊断并早期干预对青光眼临床诊治至关重要。然而,青光眼发病机制复杂,临床上尚无分子诊断生物标志物以及缺乏效果明确的视神经保护药物。细胞治疗和基因治疗是具有前景的中枢神经退行性病变治疗的可行方案。小细胞外囊泡(sEVs)是由活细胞分泌的具有磷脂双层膜结构的一类纳米级小囊泡,携带有细胞内的各种生物活性分子,如蛋白质、核酸等,被认为是细胞替代疗法和天然的基因药物递送生物纳米载体。近年来,sEVs在疾病生物标志物和基因药物递送等方面已展现出巨大的转化应用潜力。
6月25日,我院池在龙研究员团队与吴文灿教授及宁波大学附属人民医院陆勤康教授团队合作,在先进科学期刊Advanced Science 上发表题为“Circulating Small Extracellular Vesicles Involved in Systemic Regulation Respond to RGC Degeneration in Glaucoma”的原著论文。该论文首次揭示了血浆来源的小细胞外囊泡(PDEV)在青光眼生物标志物中的应用可行性及青光眼全身系统调节中的重要作用机制,为青光眼分子诊断和视神经损伤修复治疗提供了新的科学依据。李童、张文梦、王杰为该文章的共同第一作者,陆勤康、吴文灿、池在龙为共同通讯作者。

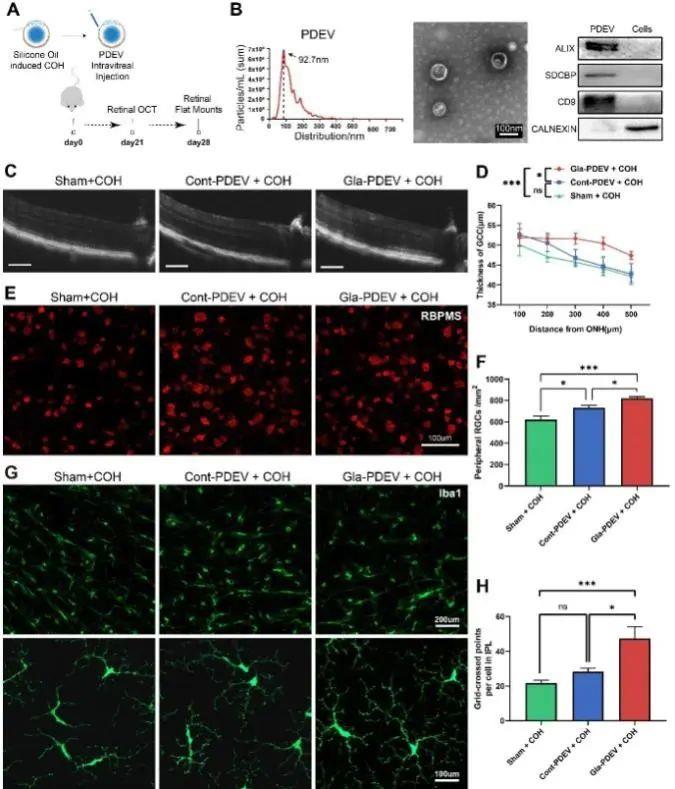
自体血清/血浆或富血小板血浆(PRP)治疗等已应用于临床,循环血及其小细胞外囊泡中是否蕴藏着全身免疫等系统性反馈调节机制?为此,该研究分离纯化了青光眼患者血浆来源小细胞外囊泡(Gla-PDEV),体内研究发现在小鼠慢性高眼压模型玻璃体腔内注射Gla-PDEV可有效减缓慢性高眼压导致的RGC丢失和小胶质细胞的活化。
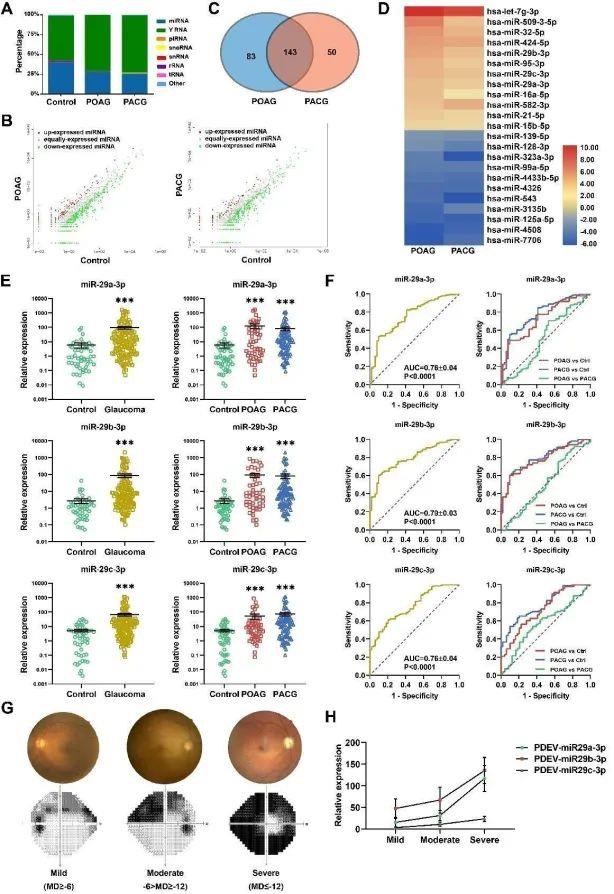
研究表明sEVs携带有细胞内生物活性分子,尤以miRNA的富集为显著。通过sRNA建库并高通量测序分析发现,Gla-PDEV中的miR-29s家族成员显著上调,并与视野损伤程度呈正相关。ROC曲线分析表明PDEV-miR-29s与青光眼视野缺损间具有较好的特异性及敏感性,或可作为青光眼早期诊断、预后评估及病程监控的潜在生物标志物。
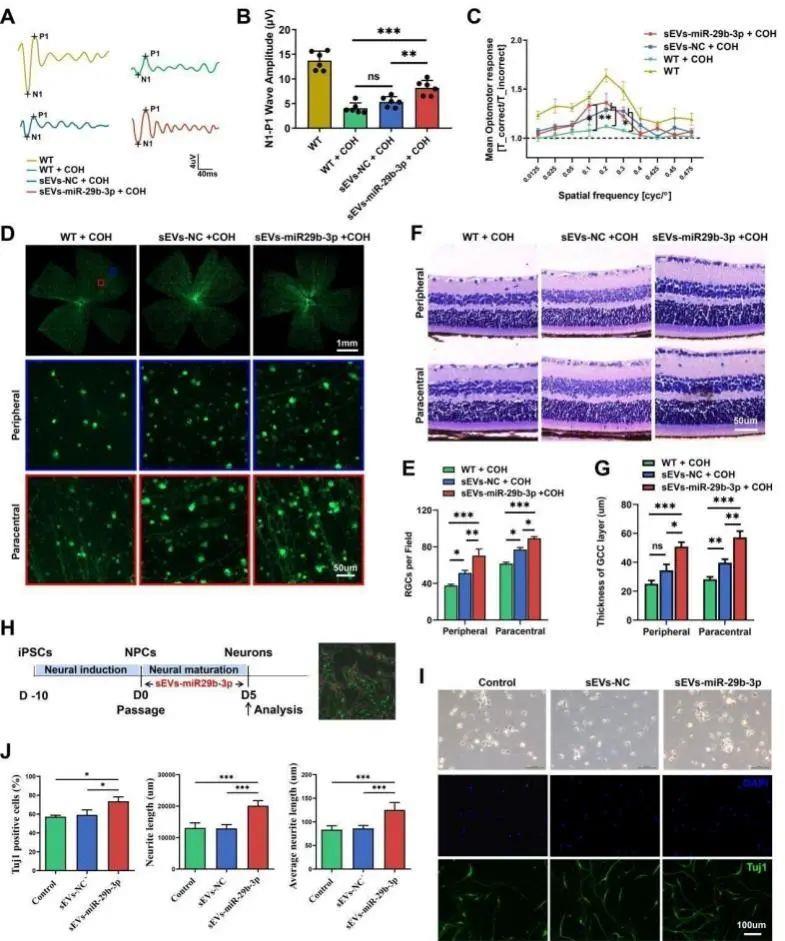
为了明确青光眼患者PDEV-miR-29s上调在视神经损伤中的潜在作用,该研究利用慢性高眼压小鼠模型和诱导多能干细胞(iPSCs)定向分化神经元的体外培养体系中进行了过表达miR-29b-3p的干预研究。结果发现,其减缓小鼠视网膜RGC丢失,视功能得到改善;同时促进了iPSCs向神经元的定向分化;明确了PTEN-mTOR信号通路的激活以及DNA甲基化相关蛋白的表达改变。鉴于此,该研究进一步利用干细胞来源sEVs制备了工程化sEVs-miR-29b-3p,发现其可以有效递送miR-29b-3p到视网膜组织,并发挥更佳的视神经保护和促进神经元定向分化。
青光眼及其视神经损伤并非眼部局限性疾病,可能存在全身系统性调节机制。小细胞外囊泡可由所有活细胞分泌,并携带有母体细胞中的生物活性分子,可通过旁分泌亦可进入循环血中发挥作用,是细胞间通讯的重要介质。该研究通过青光眼患者来源PDEV眼内注射发现其具有神经保护作用,进一步发现PDEV中的miR-29s家族显著上调,并明确了miR-29b-3p的视神经保护作用。鉴于此,该研究假设PDEV-miR-29s表达上调可能是一种全身系统反馈性调节机制。最后,该研究通过工程化sEVs-miR-29s明确了基于小细胞外囊泡递送小核酸药物进行视神经损伤保护的治疗可行性。
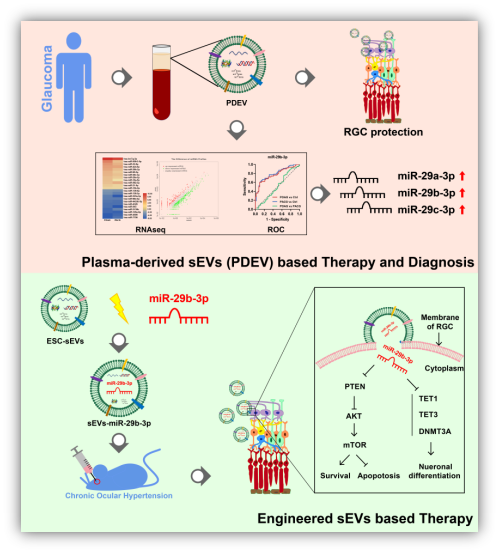
该研究阐明了青光眼视神经病变中潜在的全身调节机制,PDEV-miR-29s或可作为青光眼诊断生物标志物,自体PDEV或工程化sEVs基因药物递送是神经退行性疾病的全新治疗策略。
上一篇文章: 如何更好就诊与管控葡萄膜炎?葡萄堂开展第56期公益科普讲座
下一篇文章: 以学正风,弘扬清廉之风