视网膜色素上皮间质转化和增殖性玻璃体视网膜发病机制:温医大眼视光医院侯陵/麻晓银团队提出最新见解!
增生性玻璃体视网膜病变(PVR)是40 - 60%开放性眼球损伤患者和5 - 10%视网膜脱离患者的常见并发症。在病理情况下,视网膜色素上皮(RPE)细胞从Bruch膜脱离,发生上皮 - 间质转化(EMT)和增殖,并向玻璃体腔以及视网膜下移行聚集,导致增殖膜的产生以及收缩, 牵拉视网膜,最终影响视功能损伤,甚至失明。手术是治疗PVR的主要方法,但术后存在复发可能。而药物辅助治疗疗效不佳,阻碍了PVR临床治疗的发展。RPE细胞的EMT在PVR中起关键性作用,如何有效抑制RPE细胞EMT是PVR干预亟待解决的关键环节。RPE细胞在病理条件下的增殖和EMT与肿瘤细胞的增殖和EMT具有某些共通之处,然而抑癌基因在RPE细胞和PVR中的功能研究甚少。
近日,温州医科大学附属眼视光医院视觉健康全国重点实验室-眼发育细胞生物学与疾病研究组(侯陵/麻晓银)团队在Cell Death & Disease(中科院1区,TOP期刊,IF=8.1)上发表了题为“Absent in melanoma 2: a potent suppressor of retinal pigment epithelial-mesenchymal transition and experimental proliferative vitreoretinopathy”的文章,该团队通过人原代RPE细胞EMT模型,以及Aim2敲除小鼠PVR模型揭示抑癌因子AIM2-AKT通路抑制视网膜色素上皮细胞EMT以及PVR病变的功能作用,使用含有AKT抑制剂的眼药水治疗可减轻RPE-EMT和实验性PVR模型的严重程度。这些发现为RPE-EMT和PVR发病机制的复杂机制提供了新的见解,为靶向RPE-EMT在PVR中潜在应用的治疗策略提供了新启示。

RPE细胞在正常生理状态下是位于神经视网膜和脉络膜之间,处于相对静止状态的单层色素上皮细胞,为了探寻RPE - EMT过程中关键的基因和通路,研究人员从人眼中分离出RPE组织,对其进行酶消化和传代培养以诱导EMT和增殖(图1A、B)。通过RNA - Seq分析静息状态的RPE细胞和发生增殖EMT转变的RPE细胞的差异转录组谱型,从中发现抑癌基因黑色素瘤缺乏因子2(AIM2)在静息状态的人原代RPE(phRPE)中高表达,在发生EMT和增殖的phRPE细胞中显著下调(图1C-I)。
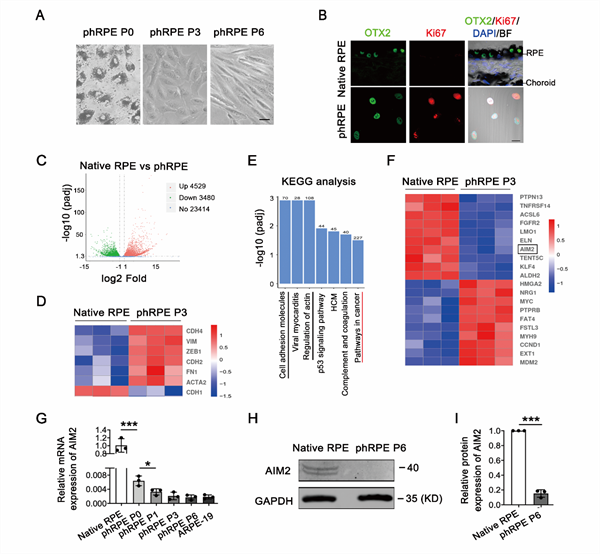
图1.人原代RPE细胞EMT和增殖过程伴随AIM2表达下调
为了明确体内RPE细胞中AIM2的高表达是否是抑制RPE细胞增殖和EMT,维持RPE细胞稳态的重要因素,研究人员分离phRPE后立即用慢病毒 - AIM2(Lv - AIM2)感染RPE细胞。通过绿色荧光蛋白(GFP)和Ki67的双重免疫染色比较未感染RPE细胞与Lv - GFP - RPEs或Lv - AIM2 - RPEs之间的细胞增殖情况。未感染和Lv - GFP - RPEs均呈现增殖状态。相比之下,Lv - AIM2 - RPEs增殖缓慢(图2D和E)。同时,AIM2过表达抑制EMT相关蛋白的表达水平,并显著抑制phRPE细胞的迁移能力和阻碍phRPE细胞介导的胶原蛋白基质胶收缩(图2F-L)。因此,这些结果表明AIM2的高表达抑制RPE细胞的增殖和EMT。
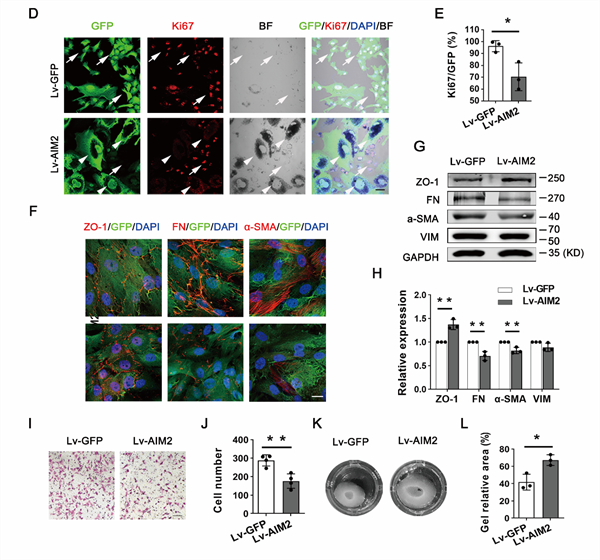
图2.AIM2高表达抑制人原代RPE细胞增殖和EMT
由于RPE - EMT在PVR的病理进展中起着至关重要的作用,研究人员通过制造孔源性视网膜脱离诱导的PVR小鼠模型,研究AIM2在PVR模型中对RPE – EMT及PVR进展的调控作用。为了模拟孔源性视网膜脱离诱发PVR的病理情况,研究人员通过注射器刺破小鼠视网膜并向小鼠视网膜下腔注射0.25%透明质酸钠来诱导孔源性视网膜脱离,从而在小鼠体内触发类似PVR的表型(图3A)。10天后,Aim2-/-小鼠的RPE细胞迁移到视网膜下腔,形成PVR增殖膜以及局部视网膜牵拉和变形(图3B)。进一步分析该PVR模型中RPE细胞的状态,发现Aim2-/-小鼠的RPE细胞EMT相关蛋白发生明显改变(图3C-E),同时,迁移到视网膜下腔的RPE细胞出现增殖(图3F和G)。研究人员进一步通过眼底彩照、光学相干断层扫描图像和苏木精-伊红染色评估Aim2-/-小鼠RPE状态变化对PVR进展的影响。评估发现Aim2-/-小鼠形成明显视网膜下膜和前膜,导致视网膜收缩和折叠,并且增殖膜的面积和发生频率明显大于野生型小鼠对照组。而临床患者的PVR增殖膜样本中AIM2表达明显低于在体的RPE细胞的结果,进一步证明了AIM2的表达下降和PVR进展的关联性(图3K)。这一系列结果表明,AIM2缺乏促使RPE细胞发生EMT和增殖,导致严重的PVR进展。
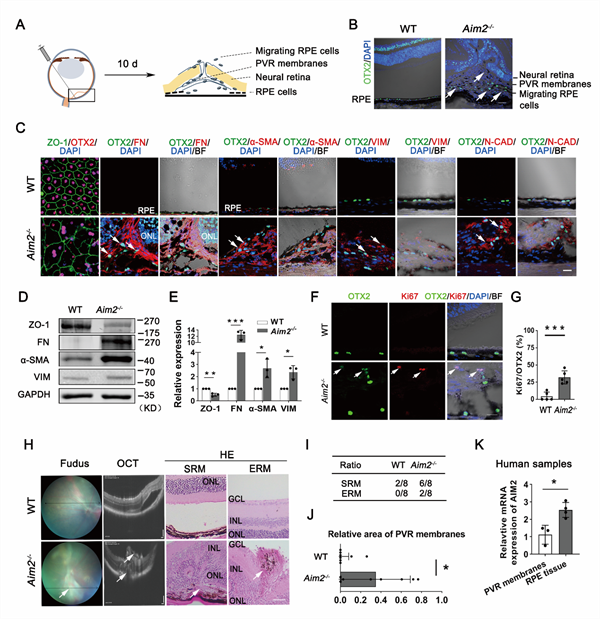
图3.AIM2缺失促使RPE细胞增殖和EMT,导致严重的PVR表型
为了探究AIM2调控RPE细胞EMT的分子机制,研究人员基于静息状态phPRE细胞与培养的phRPE细胞的RNA - Seq数据进行了KEGG分析,结果显示PI3K - AKT信号通路在发生增殖和EMT的RPE细胞中发生了明显的改变(图4E)。研究人员进一步研究发现,过表达AIM2的phRPE细胞中AKT磷酸化水平降低,并且调控AKT磷酸化的DNA依赖性蛋白激酶(DNA - PK)的磷酸化水平也显著降低(图4F和G)。此外, Aim2−/− PVR小鼠中的RPE细胞的AKT磷酸化水平增加(图4H-J)。这些结果表明,AIM2缺失会导致实验性PVR小鼠模型的RPE细胞中的AKT激活(这种激活方式不依赖于炎性小体途径),而在RPE细胞中过表达AIM2可以抑制AKT激活。
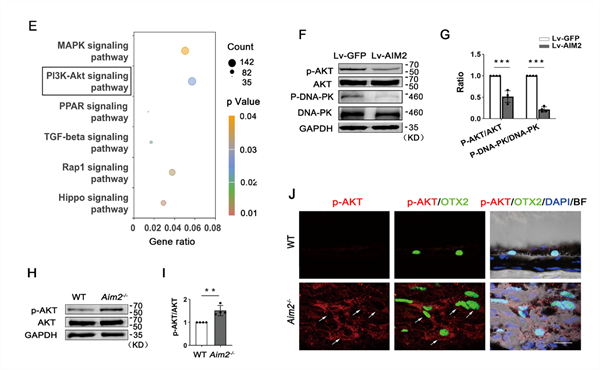
图4.AIM2以非炎性小体依赖性的方式抑制RPE细胞中AKT磷酸化
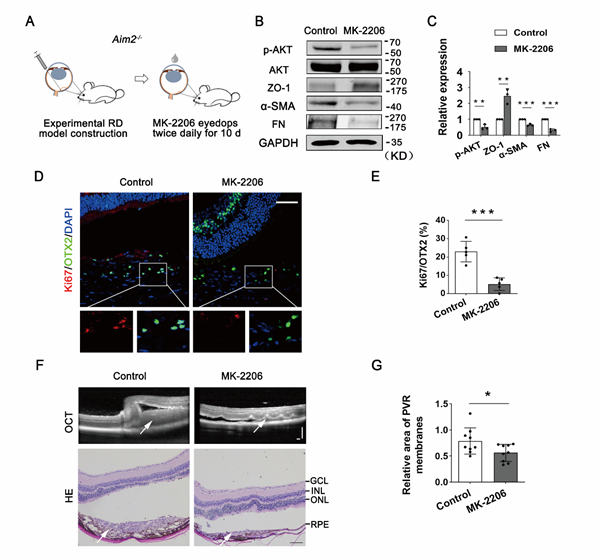
研究人员通过特异性的AKT抑制剂(MK2206)滴眼(图5A),发现MK2206给药抑制Aim2−/− PVR小鼠RPE细胞中的AKT磷酸化,从而抑制EMT相关蛋白的表达(图5B和C)。同时,MK2206抑制Aim2−/− PVR小鼠中RPE细胞的增殖(图5D和E)。进一步对增殖膜进行分析,发现MK2206能抑制Aim2−/−小鼠PVR增殖膜面积(图5F和G)。这些结果表明,抑制AKT激活可抑制RPE - EMT和增殖,从而阻止实验性PVR的进展。
综上所述,本研究发现AIM2在静息状态的phRPE细胞中高表达,但在培养的发生增殖和EMT的phRPE细胞中低表达,进一步研究发现AIM2通过调控AKT磷酸化抑制RPE - EMT和PVR进展,含有AKT抑制剂的眼药水能抑制Aim2 −/− PVR小鼠RPE - EMT和PVR进展。本研究揭示AIM2-AKT调控RPE细胞EMT对PVR的作用机制,为PVR干预治疗提供新思路和潜在靶点。虽然本研究证明AIM2通过非炎症小体依赖性通路在维持RPE稳态方面起着重要作用,但有研究表明AIM2炎性小体的激活可导致其他组织的细胞例如中枢神经元焦亡。故此,高水平AIM2表达是有益还是有害可能取决于特定的细胞环境。因此,在进一步将AIM2作为靶点应用于PVR之前,需要确定调控RPE中AIM2表达的上游信号并探索诱导内源性AIM2表达的策略至关重要,以明确其诱导作用对RPE - EMT和PVR进展是有保护作用还是有害作用。本研究通过AKT抑制剂能部分挽救AIM2缺陷导致的PVR,这表明抑制AKT是减少PVR进展的一个可行选择。
温州医科大学附属眼视光医院眼发育细胞生物学与疾病研究组陈瑜和研究生蒋明园、李莉苹为本文共同第一作者。侯陵研究员和麻晓银研究员为本文共同通讯作者。该工作得到了国家自然科学基金、浙江省自然基金的资助支持。
上一篇文章: 没有了
下一篇文章: 《眼健康科普馆建设及运营规范》团体标准发布并出版